Beoordelingsproces dure geneesmiddelen
Juli 2025
Achtergrond
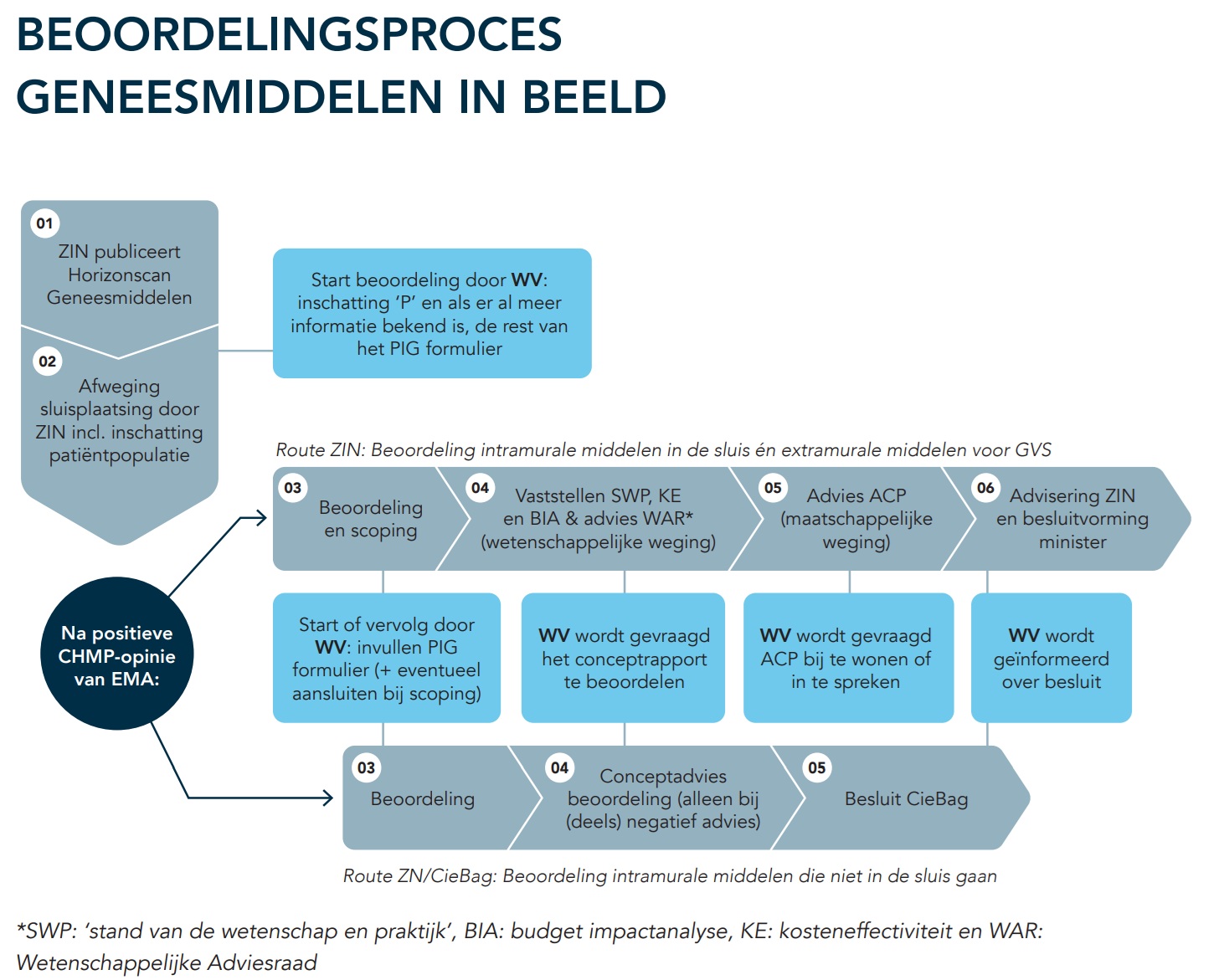
Het proces van indiening van een (duur) geneesmiddel bij de autoriteiten tot opname in het pakket verzekerde zorg is een tijdrovend en complex proces. Op verschillende momenten in dit proces, maar ook ervoor en soms erna, is inhoudelijke input van een wetenschappelijke vereniging zoals de NVALT vereist. Deze input kan gevraagd worden door vele partijen, zoals het Zorginstituut (ZiNL), de Commissie Beoordeling Add-on Geneesmiddelen (cieBAG) van Zorgverzekeraars Nederland (ZN) de wetenschappelijke adviesraad commissie geneesmiddelen (WAR-CG), patiëntenorganisaties, enzovoort.
De Federatie Medisch Specialisten (FMS) heeft hier samen met het ZiNL en ZN in 2024 een richtsnoer voor opgesteld (Beoordelingsproces geneesmiddelen vanuit perspectief wetenschappelijke vereniging, beoordelingsproces_geneesmiddelen.pdf). Elke wetenschappelijke vereniging dient daarvoor een interne structuur voor op te stellen, waarbij het Praktijkbeschrijving introductie geneesmiddelen (PIG)-formulier een rol speelt om dit te stroomlijnen. Met de invoering van de Europese Health Technology Assessment Regulation (HTAR) in 2025 is dit proces nog uitgebreid met een PICO indien een geneesmiddel Europees beoordeeld wordt. Een figuur uit dit richtsnoer staat hieronder.